Hauptinhalt
Topinformationen
Pressemeldung
Nr. 58 / 2022
26. Oktober 2022 : Spektakuläre Einblicke in den Magen der Zelle: Biologen der Uni Osnabrück klären mit neuem Hochleistungsmikroskop wichtige 3D-Struktur auf
Wie es Zellen gelingt, aufgenommene Nahrung oder Viren wie das Coronavirus SARS-CoV2 zum zellulären Magen zu bringen und zu zerlegen, hat ein Forschungsteam der Universität Osnabrück im Detail untersucht. Eine zentrale Rolle für diesen Vorgang nimmt der sogenannte HOPS-Komplex ein. Er steuert, dass Transportbläschen mit dem zellulären Magen verschmelzen und ihren transportierten Inhalt zur Verdauung freigeben. Jetzt konnte erstmalig die 3D-Struktur dieser zellulären Nanomaschine HOPS durch modernste Mikroskopie-Technik gelöst werden. Die Studie wurde unter dem Titel „Structure of the HOPS tethering complex, a lysosomal membrane fusion machinery“ in der Fachzeitschrift eLife veröffentlicht.
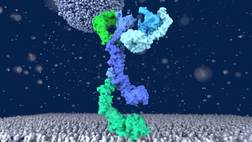
© UOS/ Arne Möller
3D-Mikroskopaufnahme des HOPS-Komplexes, einer 43 Nanometer kleinen Struktur innerhalb der Zelle, die wichtig ist, um Nahrung oder Viren in den Zellmagen zu befördern. Copyright: UOS/ Arne Möller
Wenn Zellen Nahrung aufnehmen, wird diese in Transportbläschen (auch Vesikel genannt) zum Zellmagen (dem Lysosom) transportiert, mit dem sie verschmelzen und so ihre Fracht abgeben. Auf die gleiche Weise werden auch Viren, wie z.B. das allgegenwärtige Coronavirus, im Zellmagen abgebaut und damit neutralisiert. Die verdaute Nahrung nutzt die Zelle dann für den Bau neuer Bestandteile.
Der HOPS-Komplex ist nur 43 Nanometer groß. Zum Vergleich: ein Nanometer ist ein Millionstel von einem Millimeter. Dieser Proteinkomplex verknüpft das Vesikel mit dem Zellmagen und sorgt dafür, dass die Membranen beider Partner miteinander verschmelzen können. „Am HOPS-Komplex und dem Prozess der Fusion von Vesikeln mit dem Zellmagen forschen wir bereits recht lange und wissen genau, welche Proteinkomplexe daran beteiligt sind. Wie diese molekulare Maschinerie jedoch am Zellmagen funktioniert, wussten wir bis jetzt nicht“, erklärt Professor Christian Ungermann, der die Abteilung Biochemie an der Universität Osnabrück leitet.
Über die vergangenen zwei Jahre hat Professor Arne Möller, Leiter der Abteilung Strukturbiologie, in Osnabrück die Kryo-Elektronenmikroskopie etabliert, die 2017 mit dem Nobelpreis geehrt wurde. Herzstück in Osnabrück ist ein drei Millionen Euro teures Kryo-Elektronenmikroskop – ein Forschungsgroßgerät, mit dem es möglich ist, Proteine mit hunderttausendfacher Vergrößerung zu untersuchen. Vor einem Jahr wurde das Mikroskop im Zentrum für zelluläre Nanoanalytik (CellNanOs) installiert. „Das Mikroskop ist ca. zwei Tonnen schwer und richtig groß. Es ist hoch sensibel. Deshalb steht es sehr stabil in einem speziell dafür hergerichteten Raum im CellNanOs auf einem 70 Tonnen schweren Betonsockel“, erklärt Professor Möller. „Es ist immer wieder faszinierend, dass wir mit diesem Mikroskop etwas so Kleines wie den HOPS-Komplex direkt betrachten können. Oft sind wir die ersten Menschen, die eine solche Nanomaschine mit den eigenen Augen sehen können“, ergänzt er.
Bevor man jedoch die dreidimensionale Struktur des Komplexes vor sich hat, müssen viele tausend Aufnahmen miteinander verrechnet werden. Dazu setzen die Biologen einen extra dafür angeschafften hochmodernen Großrechner ein. „Für mich als Strukturbiologe ist die vorliegende 3D-Struktur in ihren filigranen Details spektakulär, nicht nur weil er aussieht wie ein Handballspieler. Anhand unserer Daten können wir jetzt endlich erklären, wie zwei Prozesse – die Erkennung von Vesikeln und deren Verschmelzung mit dem Zellmagen – gekoppelt werden“, so Professor Möller. „Dass wir so schnell mit dem neuen Großgerät signifikante Forschungserfolge erzielen konnten, freut uns enorm.“
Professor Ungermann betont die ausgezeichnete Zusammenarbeit der beiden Arbeitsgruppen, und hebt den engen Austausch der drei Erstautoren Dmitry Shvarev, Jannis Schoppe und Caroline König hervor. Er fügt hinzu: „Unsere Studie wird von vielen Kolleginnen und Kollegen als ‚Durchbruch‘ bezeichnet. Selten habe ich so viele positive Rückmeldungen nach einem Vortrag bekommen wie nach der Präsentation der HOPS-Struktur.“
Coronavirus überwindet die natürliche Verteidigung
Auch das Coronavirus SARS CoV2 wird in Vesikeln eingeschlossen und zum Zellmagen transportiert. Es habe leider einen Weg gefunden, den HOPS-Komplex teilweise auszuschalten und so die natürliche Verteidigung der Zelle zu überwinden: „Wir wissen bereits sehr gut, wie Viren in unsere Zellen eindringen. Doch wie es Zellen gelingt, diese Viren unschädlich zu machen, das ist noch nicht restlos aufgeklärt. Klar ist: Viren müssen zunächst in den Zellmagen gelangen, um zerstört zu werden“, so Professor Ungermann. „Das Coronavirus stellt zusätzlich ein Protein her, das den HOPS-Komplex blockiert. Durch diesen Trick haben Coronaviren genügend Zeit, ihre genetische Information in die Zelle zu schleusen und sich weiter zu vermehren.“
Für Professor Möller braucht es mikroskopische Einblicke in die Prozesse des Körpers, die auf der Skala von Nanometern stattfinden: „Wenn man etwas sehen kann, kann man auch verstehen, wie es funktioniert. Wir wissen jetzt viel mehr über den Mechanismus des HOPS-Komplexes als vorher, aber es bleibt auch noch viel zu tun.“ Die Studie wurde durch Mittel der Deutschen Forschungsgemeinschaft (DFG) im Rahmen eines Gemeinschaftsprojektes von Professor Möller und Professor Ungermann ermöglicht. Weitere Mittel stellte der Sonderforschungsbereich 944 „Dynamik und Physiologie zellulärer Mikrokompartimente“ zur Verfügung.
Zur Veröffentlichung: https://elifesciences.org/articles/80901
Weitere Informationen: https://cellnanos.uni-osnabrueck.de